![]()
![]()
1.4|LIÊN
KẾT HÓA HỌC GIỮA CÁC NGUYÊN TỬ VÀ PHÂN TỬ TRONG TINH THỂ
Chúng ta đang xem
xét những cấu trúc đơn tinh thể khác nhau. Câu hỏi
nảy sinh là tại sao một cấu trúc tinh thể nào
đó lại thiên về một cách tổ hợp các nguyên tử
theo cách riêng của nó. Một định luật cơ bản
trong tự nhiên là năng lượng tổng trong một hệ
ở trạng thái cân bằng nhiệt có khuynh hướng
đạt đến giá trị cực tiểu. Tương
tác xuất hiện giữa những nguyên tử để
hình thành nên chất rắn nhằm đạt đến
năng lượng toàn phần cực tiểu và
tương tác này phụ thuộc vào từng loại nguyên
tử. Do đó, loại liên kết hoặc tương tác
giữa những nguyên tử phụ thuộc vào nguyên tử
cụ thể hoặc những nguyên tử trong tinh thể.
Nếu không có liên kết mạnh giữa những nguyên tử,
chúng sẽ “không dính” với nhau để tạo nên chất
rắn.
Tương tác giữa những nguyên tử
có thể được mô tả theo cơ học lượng
tử. Mặc dù những kiến thức về cơ học
lượng tử được đưa vào trong
chương sau nhưng sự mô tả các liên kết hóa học
trong nguyên tử theo cơ học lượng tử vẫn
nằm ngoài phạm vi nghiên cứu của tài liệu này.
Tuy nhiên, chúng ta có thể thu được những kiến
thức định tính về cách thức tương tác của
những nguyên tử bằng cách xem xét những electron lớp
ngoài cùng hay những electron hóa trị trong nguyên tử.
Những nguyên tử tại 2 biên của bảng
tuần hoàn (ngoại trừ khí trơ ) có khuynh hướng
mất hoặc thu electron hóa trị để hình thành những
Ion. Do đó, về cơ bản những ion này có lớp
năng lượng ngoài cùng đầy hoàn toàn. Những
nguyên tố ở nhóm I của bảng tuần hoàn có khuynh
hướng mất một electron của chúng và trở
thành ion mang điện dương, trong khi những nguyên tố
ở nhóm VII của bảng tuần hoàn có khuynh hướng
thu thêm một electron và trở thành ion mang điện âm. Những
ion mang điện dương này sẽ tương tác
Coulomb và hình thành liên kết được gọi là liên kết
ion. Nếu những ion này đến gần nhau thì lực
đẩy sẽ chiếm ưu thế vì vậy có một
khoảng cách cân bằng giữa hai ion này. Trong tinh thể,
những ion mang điện âm có khuynh hướng bị bao
quanh bởi những ion mang điện dương và những ion mang điện
dương có khuynh hướng bị bao quanh bởi những
ion mang điện âm, vì vậy mạng tuần hoàn nguyên tử
được hình thành để tạo nên mạng tinh thể.
Ví dụ điễn hình của liên kết ion là NaCl. Video
sau đây sẽ biễu diễn quá trình hình thành liên kết
ion giữa nguyên tử Na và nguyên tử Clo.
Tương tác giữa những nguyên tử
có khuynh hướng hình thành những lớp đầy hoàn
toàn như chúng ta thấy trong liên kết ion. Một liên kết
nguyên tử khác có  khuynh
hướng đạt đến những lớp đầy
là liên kết cộng hóa trị, ví dụ như trong phân tử
hidro. Nguyên tử hidro có một electron và cần một
electron nữa để có thể lấp đầy lớp
năng lượng thấp nhất. Sơ đồ của
hai nguyên tử hidro không tương tác và phân tử hidro với
liên kết cộng hóa trị được biễu diễn
trong hình 1.15. Liên kết cộng hóa trị dẫn đến
việc dùng chung electron giữa những nguyên tử, kết
quả là lớp electron hóa trị của mỗi nguyên tử
sẽ đầy. Video sau mô tả quá trình hình thành liên kết
cộng hóa trị của phân tử hidro và phân tử nước
(Hydrogen: nguyên tử hidro, hydrogen molecule: phân tử hidro, water
molecule: phân tử nước).
khuynh
hướng đạt đến những lớp đầy
là liên kết cộng hóa trị, ví dụ như trong phân tử
hidro. Nguyên tử hidro có một electron và cần một
electron nữa để có thể lấp đầy lớp
năng lượng thấp nhất. Sơ đồ của
hai nguyên tử hidro không tương tác và phân tử hidro với
liên kết cộng hóa trị được biễu diễn
trong hình 1.15. Liên kết cộng hóa trị dẫn đến
việc dùng chung electron giữa những nguyên tử, kết
quả là lớp electron hóa trị của mỗi nguyên tử
sẽ đầy. Video sau mô tả quá trình hình thành liên kết
cộng hóa trị của phân tử hidro và phân tử nước
(Hydrogen: nguyên tử hidro, hydrogen molecule: phân tử hidro, water
molecule: phân tử nước).
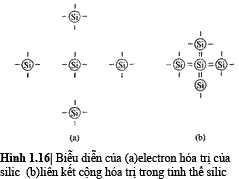 Những nguyên tử nhóm IV của
bảng tuần hoàn, ví dụ như Si và Ge cũng có khuynh
hướng hình thành liên kết cộng hóa trị. Những
nguyên tố này có 4 electron hóa trị
và cần thêm 4 electron hóa trị
để đạt đến cấu hình bền vững.
Chẳng hạn, nếu một nguyên tử silic có 4 nguyên tử
lân cận gần nhất, trong đó mỗi nguyên tử
đóng góp một electron hóa trị để dùng chung thì
nguyên tử ở giữa sẽ có 8 electron ở lớp
ngoài cùng. Hình 1.16a biễu diễn năm nguyên tử silic
không tương tác trong đó mỗi nguyên tử có 4 electron
hóa trị. Hình 1.16b là biễu diễn hai chiều của liên
kết cộng hóa trị trong silic.Nguyên tử ở trung
tâm có 8 electron hóa trị.
Những nguyên tử nhóm IV của
bảng tuần hoàn, ví dụ như Si và Ge cũng có khuynh
hướng hình thành liên kết cộng hóa trị. Những
nguyên tố này có 4 electron hóa trị
và cần thêm 4 electron hóa trị
để đạt đến cấu hình bền vững.
Chẳng hạn, nếu một nguyên tử silic có 4 nguyên tử
lân cận gần nhất, trong đó mỗi nguyên tử
đóng góp một electron hóa trị để dùng chung thì
nguyên tử ở giữa sẽ có 8 electron ở lớp
ngoài cùng. Hình 1.16a biễu diễn năm nguyên tử silic
không tương tác trong đó mỗi nguyên tử có 4 electron
hóa trị. Hình 1.16b là biễu diễn hai chiều của liên
kết cộng hóa trị trong silic.Nguyên tử ở trung
tâm có 8 electron hóa trị.
Một sự khác nhau cơ bản giữa
liên kết cộng hóa trị của hidro và của silic là
khi phân tử hidro được hình thành, nó không có những
electron được thêm vào để hình thành thêm những
liên kết cộng hóa trị, trong khi những nguyên tử
silic bên ngoài luôn luôn có sẵn những electron hóa trị
để hình thành thêm những liên kết cộng hóa trị.
Do đó, mạng những nguyên tử silic hình thành nên một
tinh thể có kích thướt không xác định, trong
đó mỗi nguyên tử silic có 4 nguyên tử lân cận gần
nhất và 8 electron được dùng chung. Bốn nguyên tử
lân cận gần nhất hình thành nên liên kết cộng hóa
trị tương ứng với cấu trúc tứ diện
và mạng kim cương, nó lần lượt được
biễu diễn trong hình 1.11 và 1.10. Tất nhiên, liên kết
nguyên tử và cấu trúc tinh thể có liên hệ trực tiếp
với nhau.
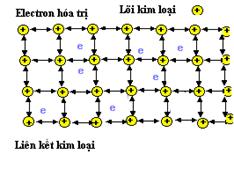 Loại liên kết nguyên tử
thứ 3 là liên kết kim loại. Những nguyên tố nhóm
I có một electron hóa trị. Chẳng hạn, nếu hai
nguyên tử Natri (Z=11) được mang đến gần
nhau, những electron hóa trị sẽ tương tác với
nhau giống như trong liên kết cộng hóa trị. Khi
nguyên tử Natri thứ 3 được mang đến gần
hai nguyên tử đầu, những electron hóa trị
cũng có thể tương tác và tiếp tục hình thành một
liên kết. Natri ở thể rắn có cấu trúc lập
phương tâm khối, vì vậy mỗi nguyên tử có 8
nguyên tử lân cận gần nhất trong đó mỗi
nguyên tử góp vào một electron. Chúng ta có thể xem
những ion dương kim loại được vây quanh bởi
một biển các electron, chất rắn được giữ
với nhau bởi lực tĩnh điện. Sự mô tả
này cho ta một bức tranh định tính về liên kết
kim loại.
Loại liên kết nguyên tử
thứ 3 là liên kết kim loại. Những nguyên tố nhóm
I có một electron hóa trị. Chẳng hạn, nếu hai
nguyên tử Natri (Z=11) được mang đến gần
nhau, những electron hóa trị sẽ tương tác với
nhau giống như trong liên kết cộng hóa trị. Khi
nguyên tử Natri thứ 3 được mang đến gần
hai nguyên tử đầu, những electron hóa trị
cũng có thể tương tác và tiếp tục hình thành một
liên kết. Natri ở thể rắn có cấu trúc lập
phương tâm khối, vì vậy mỗi nguyên tử có 8
nguyên tử lân cận gần nhất trong đó mỗi
nguyên tử góp vào một electron. Chúng ta có thể xem
những ion dương kim loại được vây quanh bởi
một biển các electron, chất rắn được giữ
với nhau bởi lực tĩnh điện. Sự mô tả
này cho ta một bức tranh định tính về liên kết
kim loại.
Một loại liên kết nguyên tử thứ
4 là liên kết Van der Waal. Đây là liên kết yếu nhất
trong các liên kết hóa học. Chẳng hạn, phân tử HF
được hình thành bởi liên kết ion. Tâm hiệu dụng
của những hạt mang điện dương không
trùng với tâm hiệu dụng của những hạt mang
điện âm. Sự bất đối xứng trong phân bố
điện tích dẫn đến sự hình thành một
lưỡng cực điện nhỏ có thể
tương tác với những lưỡng cực của
các phân tử HF khác. Bởi vì tương tác yếu, chất
rắn được hình thành bởi liên kết Van der
Waals có nhiệt độ nóng chảy tương đối
thấp – quả thực hầu hết các vật liệu
này tồn tại ở dạng khí trong điều kiện
nhiệt độ phòng.
Xem video mô tả sự
hình thành phân tử HF bằng liên kết Van der Waal.
![]()